BGH, Urteil vom 31.07.2012 - Aktenzeichen X ZR 19/10
Patentfähigkeit eines Patents betreffend mit Druck beaufschlagte Dosierinhalatoren (pressurised metered dose inhalers, MDI) bei Enthalten einer Zusammensetzung mit dem Wirkstoff Budesonid
Tenor
Auf die Berufung der Klägerin wird das am 27. Oktober 2009 verkündete Urteil des 3. Senats (Nichtigkeitssenats) des Bundespatentgerichts abgeändert.
Das europäische Patent 1 131 051 wird mit Wirkung für die Bundesrepublik Deutschland für nichtig erklärt.
Die Beklagte trägt die Kosten des Rechtsstreits.
Tatbestand
Die Beklagte ist Inhaberin des mit Wirkung für die Bundesrepublik Deutschland erteilten europäischen Patents 1 131 051 (Streitpatents), das am 23. November 1999 unter Inanspruchnahme der Priorität zweier italienischer Anmeldungen vom 25. November 1998 und vom 30. Juli 1999 angemeldet worden ist und Druckdosierinhalatoren betrifft. Patentanspruch 1, auf den die übrigen elf Patentansprüche zurückbezogen sind, lautet in der Verfahrenssprache:
"Pressurised metered dose inhalers containing a composition for aerosol administration containing a solution of budesonide or epimers thereof, an hydrofluorocarbon propellant and a co-solvent, part or all of the internal surfaces of said inhalers consisting of stainless steel, anodised aluminium or being lined with an inert organic coating selected from perfluoroalkoxyalkane, epoxy-phenol resin or fluorinated- ethylene-propylene polyether sulfone."
Die Klägerin hat geltend gemacht, der Gegenstand des Streitpatents sei nicht patentfähig. Das Patentgericht hat die Klage abgewiesen. Dagegen richtet sich die Berufung der Klägerin, die weiterhin die Nichtigerklärung des Streitpatents anstrebt. Die Beklagte tritt dem Rechtsmittel entgegen.
Im Auftrag des Senats hat Prof. Dr. ... S. ... , ein schriftliches Gutachten erstellt, das er in der mündlichen Verhandlung erläutert und ergänzt hat. Die Klägerin hat Privatgutachten von Prof. Dr. ... B. ... . H. und Prof. Dr. ... D. vorgelegt, die Beklagte zwei Privatgutachten von Dr. ... C. ... .
Entscheidungsgründe
Die zulässige Berufung ist begründet.
I. Das Streitpatent betrifft mit Druck beaufschlagte Dosierinhalatoren (pressurised metered dose inhalers, MDI), die eine Zusammensetzung mit dem Wirkstoff Budesonid enthalten.
1. Im Stand der Technik waren verschiedene Druckdosierinhalatoren zur Verabreichung von Arzneimitteln in die Atemwege mittels Inhalation bekannt. Solche Inhalatoren enthalten eine pharmazeutisch wirksame Zusammensetzung, die einen Wirkstoff in gelöster Form oder als Suspension enthält, sowie ein Treibmittel, das es ermöglicht, die Zusammensetzung als Aerosol, also in Form von kleinen, von Gas umgebenen Tröpfchen oder Festpartikeln auszustoßen, und das unter Umständen zugleich als Lösungsmittel fungieren kann.
Zu den in dieser Weise verabreichten Wirkstoffen gehört Budesonid, ein Glucocorticoid, das unter anderem zur Behandlung von asthma bronchiale eingesetzt wird.
Als Treibmittel wurden früher bestimmte Chlorfluorkohlenstoffe (chloro- fluorocarbon, CFC, auch bezeichnet als Fluorchlorkohlenwasserstoffe, FCKW) eingesetzt. Diese wurden in neuerer Zeit mit der Zerstörung der Ozonschicht in Verbindung gebracht. Als umweltschonendere Alternative wurden Fluoralkane (hydrofluoroalkan, HFA, auch als Fluorkohlenwasserstoffe, hydrofluorocarbon oder HFC bezeichnet) vorgeschlagen, insbesondere 1,1,1,2-Tetrafluorethan (HFA 134a) und 1,1,1,2,3,3,3-Heptafluorpropan (HFA 227).
Nach den Ausführungen in der Streitpatentschrift treten bei bestimmten Wirkstoffen und Treibmitteln Stabilitätsprobleme auf. Bei Suspensionen betreffen diese meist die physikalische Stabilität, die zum Beispiel durch unerwünschte Partikelvergrößerung oder Ausflocken beeinträchtigt werden kann. Bei Lösungen kommt es häufig zu chemischer Instabilität, also zu einer Zersetzung des Wirkstoffs.
Das Streitpatent betrifft das technische Problem, einen Druckdosierinhalator zur Verfügung zu stellen, der eine physikalisch und chemisch stabile Zusammensetzung mit Budesonid und einem FCKW-freien Treibmittel enthält.
2. Zur Lösung dieses Problems schlägt Patentanspruch 1 des Streitpatents einen mit Druck beaufschlagten Dosierinhalator vor, der folgende Merkmale aufweist:
1. Der mit Druck beaufschlagte Dosierinhalator [1] enthält
a) eine Zusammensetzung für die Aerosolverabreichung [2], die
a1) eine Lösung [3]
a2) von Budesonid oder Epimeren davon [4] enthält, b) ein Fluorkohlenwasserstofftreibmittel [5] und
c) ein Cosolvens.
2. Zumindest ein Teil der Innenoberflächen der Inhalatoren [7]
a) besteht aus
a1) Edelstahl [7.1] oder
a2) anodisiertem Aluminium [7.2]
b) oder ist mit einer inerten organischen Beschichtung ausgekleidet [7.3], die ausgewählt ist aus
b1) einem Perfluoralkoxyalkan [7.4],
b2) einem Epoxy-Phenol-Harz [7.5] oder
b3) einem fluorierten Ethylen-Propylen-Polyethersulfon
[7.6].
II. Das Patentgericht hat seine Entscheidung im Wesentlichen wie folgt begründet:
Der Gegenstand des Streitpatents sei dem Fachmann, einem Pharmazeuten, der sich auf das Gebiet der pharmazeutischen Technologie spezialisiert habe, über mehrjährige Erfahrung in der Entwicklung von pharmazeutischen Formulierungen, insbesondere von Inhalationspräparaten verfüge und mit einem organischen Chemiker sowie einem Fachmann für Arzneimittelverpackungen zusammenarbeite, nicht durch den Stand der Technik nahegelegt.
Für den Fachmann habe es auf der Hand gelegen, sich mit der internationalen Patentanmeldung WO 98/13031 (TM10) zu befassen, in der bereits ein mit Druck beaufschlagter Dosierinhalator mit Budesonid und einem Fluorkohlenwasserstoff als Treibmittel offenbart sei. Bei diesem Inhalator liege Budesonid als Suspension vor. Vom Einsatz einer Lösung werde in TM10 abgeraten, weil dies zu Stabilitätsproblemen führe.
Angesichts dessen habe der Fachmann keine Veranlassung gehabt, Anregungen aus der internationalen Patentanmeldung WO 95/17195 A1 (TM5) zu beziehen, die eine Dosieraerosolformulierung für Druckdosierinhalatoren mit dem Wirkstoff Flunisolid betreffe. Flunisolid sei zwar ebenfalls ein Glucocorti- coid und weise strukturelle Ähnlichkeiten mit Budesonid auf. Der Fachmann habe aber keinen hinreichenden Anlass zu der Erwartung gehabt, dass die in TM5 für Flunisolid offenbarte Formulierung geeignet sei, die in TM10 für Bude- sonid-Lösungen berichteten Stabilitätsprobleme zu überwinden.
III. Diese Beurteilung hält der Überprüfung im Berufungsverfahren in einem entscheidenden Punkt nicht stand.
1. Der Gegenstand von Patentanspruch 1 des Streitpatents ist durch den Stand der Technik nahegelegt.
a) In der internationalen Patentanmeldung WO 95/17195 A1 (TM5) sind Aerosolformulierungen offenbart, die als Wirkstoff das Glucocorticoid Flunisolid, als Lösungs- und Treibmittel HFA 134a oder HFA 227 und als Cosolvens Ethanol umfassen.
(1) In der Beschreibung wird ausgeführt, die chemische Stabilität bestimmter erfindungsgemäßer Formulierungen könne durch Anwesenheit von Wasser, Sorbitantrioleat oder Cetypyridiniumchlorid verbessert werden (S. 5 Z. 7-30). Als geeignete Umhüllung werden herkömmliche Aerosolbehälter angeführt. Ergänzend wird dargelegt, es habe sich herausgestellt, dass bestimmte Behälter die chemische Stabilität bestimmter erfindungsgemäßer Formulierungen verbesserten und/oder die Absorption von Flunisolid an den Behälterwänden minimierten. Deshalb werde eine erfindungsgemäße Formulierung bevorzugt in Aerosolampullen aus Glas eingefasst oder in Aerosolampullen aus Aluminium mit einer inneren Kammer, die mit einem Harz beschichtet sei, das gegenüber Flunisolid inert sei und vorzugsweise Flunisolid nicht aus der Formulierung absorbiere. Als geeignete Harze werden unter anderem Epoxy-Phenol-Harze angeführt (S. 7 Z. 3-17).
Damit ist ein Druckdosierinhalator für den Wirkstoff Flunisolid mit den Merkmalen 1 a1, 1 b, 1 c und 2 b2 offenbart.
(2) Entgegen der Auffassung des Patentgerichts und der Beklagten gaben die Ausführungen in TM5 dem Fachmann, einem Pharmazeuten mit mehrjähriger Erfahrung in der Formulierung von Inhalationspräparaten, Anlass, einen Inhalator mit diesen Merkmalen auch für Budesonid in Betracht zu ziehen.
Zwar konnte der Fachmann nicht mit Sicherheit erwarten, dass der in TM5 offenbarte Lösungsweg auch für Budesonid zu dem angestrebten Ergebnis führen würde. Aus den Ausführungen in TM5 ergab sich jedoch eine hinreichend große Erfolgswahrscheinlichkeit, die durch die übrigen Entgegenhaltungen nicht entscheidend in Frage gestellt wurde. Der Fachmann hatte deshalb Anlass, Versuche der in TM5 beschriebenen Art auch mit Budesonid durchzuführen.
(a) Eine hinreichende Erfolgswahrscheinlichkeit ergab sich, wie der gerichtliche Sachverständige eingehend dargelegt hat, aus der strukturellen Ähnlichkeit der beiden Wirkstoffe Flunisolid und Budesonid.
Die genannten Wirkstoffe weisen in ihrem chemischen Aufbau bei ansonsten gleicher Struktur lediglich zwei Unterschiede auf: Bei Budesonid ist an dem aus drei Kohlenstoff- und zwei Sauerstoffatomen bestehenden 1,3-Dioxolanring eine Propylgruppe (C3H7) angefügt, bei Flunisolid stattdessen zwei Methylgruppen (CH3). Ferner ist bei Flunisolid am zweiten Ring ein Fluor-Atom angebunden.
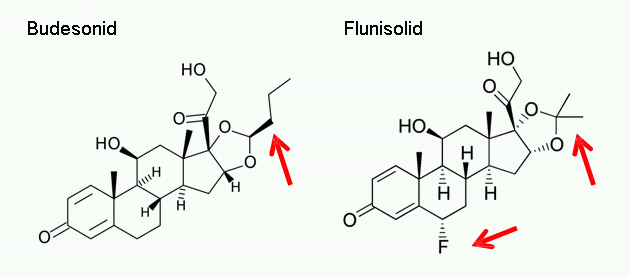
Diese strukturelle Ähnlichkeit gab zwar, wie der gerichtliche Sachverständige bestätigt hat, keinen sicheren Aufschluss darüber, ob eine Lösung von Budesonid in HFA 134a oder HFA 227 und Ethanol eine vergleichbare chemische Stabilität aufweisen würde wie die in TM5 offenbarte Flunisolid-Lösung. Der Umstand, dass beide Wirkstoffe für ähnliche Anwendungsgebiete einsetzbar sind, gab jedoch Anlass zu der Erwartung, dass sich der erhoffte Erfolg auch bei Budesonid einstellen würde. Der Fachmann hatte deshalb Veranlassung, entsprechende Versuche mit Budesonid anzustellen, zumal der Aufwand dafür, wie der gerichtliche Sachverständige ebenfalls bestätigt hat, sich in überschau-
baren Grenzen hält.
(b) Die in der Streitpatentschrift beschriebenen Probleme mit der chemischen Stabilität einer Budesonid-Lösung, zu deren Bewältigung nach dem Streitpatent die besondere Ausgestaltung des Behälters gemäß Merkmalsgruppe 2 dient, führen nicht zu einer abweichenden Beurteilung.
Dabei kann offen bleiben, ob vergleichbare Stabilitätsprobleme auch bei Flunisolid-Lösungen auftreten, wie dies die Klägerin unter Bezugnahme auf von ihr vorgelegte Versuchsergebnisse (TM28) geltend macht. Schon aus TM5 war zu entnehmen, dass die chemische Stabilität bei bestimmten Lösungen durch Zugabe weiterer Stoffe oder durch Auswahl eines geeigneten Behältermaterials verbessert werden kann. Aus diesen allgemein gehaltenen Hinweisen konnte zwar nicht entnommen werden, unter welchen konkreten Voraussetzungen Maßnahmen zur Verbesserung der Stabilität bei Flunisolid-Lösungen empfehlenswert oder sogar zwingend erforderlich sind und welche Schlussfolgerungen sich hieraus für Budesonid-Lösungen ergeben. Dennoch wurde dem Fachmann ein konkreter Weg aufgezeigt, wie er auftretenden Stabilitätsproblemen begegnen kann. Dies gab dem Fachmann Anlass, entsprechende Maßnahmen auch bei Budesonid-Lösungen in Betracht zu ziehen, falls diese ohne besondere Vorkehrungen nicht die erforderliche chemische Stabilität zeigen würden.
(c) Entgegen der Auffassung der Beklagten kann eine hinreichende Veranlassung, Stabilitätsproblemen durch Auswahl eines geeigneten Behältermaterials zu begegnen, auch nicht deshalb verneint werden, weil in TM5 und anderen Entgegenhaltungen auch andere Möglichkeiten, insbesondere die Zugabe von Komplexbildnern oder Säuren, aufgezeigt werden.
Auch wenn der Fachmann damit mehrere Varianten zur Verfügung hatte, bestand für ihn angesichts der überschaubaren Anzahl der grundlegenden Lösungsansätze Anlass, die Auswahl eines geeigneten Behältermaterials als Mittel zur Lösung von Stabilitätsproblemen in Betracht zu ziehen. Dies gilt umso mehr, als die Auswahl eines geeigneten Packmittels nach den Ausführungen des gerichtlichen Sachverständigen zu den Routinetätigkeiten eines Entwicklers gehört. Zu den danach nahegelegten Versuchen hätten, wie der gerichtliche Sachverständige bestätigt hat, nicht nur solche mit der in TM5 hervorgehobenen Innenbeschichtung aus Epoxy-Phenol-Harz gehört, sondern auch Versuche mit den anderen in Merkmalsgruppe 2 alternativ aufgeführten Behältermaterialien.
Vor diesem Hintergrund ist auch irrelevant, dass der Auswahl eines geeigneten Behältermaterials in TM5 Relevanz nicht nur für die Verbesserung der Stabilität beigemessen wird, sondern alternativ oder zusätzlich auch für die Verhinderung einer Absorption des Wirkstoffs an der Behälterwand. Der Fachmann hatte im Hinblick auf diese Ausführungen Anlass, der Auswahl des Materials sowohl unter dem einen als auch unter dem anderen Gesichtspunkt besondere Bedeutung beizumessen, Versuche mit unterschiedlichen Behältermaterialien mithin auch dann durchzuführen, wenn sich lediglich Stabilitätsprobleme, aber keine Absorptionseffekte zeigten.
b) Die Ausführungen in der internationalen Patentanmeldung WO 98/13031 (TM10) führen entgegen der Auffassung des Patentgerichts nicht zu einer abweichenden Beurteilung.
(1) Der Umstand, dass TM10 die Verbesserung von Suspensionsformulierungen für Budesonid betrifft, gab dem Fachmann keinen Anlass, für Budesonid ausschließlich Suspensionen in Betracht zu ziehen und von Versuchen
mit Lösungen der in TM5 beschriebenen Art abzusehen.
Dabei kann dahingestellt bleiben, ob mit den in TM10 offenbarten Zusammensetzungen aus einer Budesonid-Suspension, einem HFA-Treibmittel und einem Hilfsstoff wie beispielsweise Ethanol die bei Suspensionsformulierungen häufig auftretenden Probleme mit der physikalischen Stabilität in jeder Hinsicht befriedigend gelöst werden können. Selbst wenn dies der Fall wäre, hätte der Fachmann Veranlassung gehabt, auch für Budesonid weitere Formulierungsmöglichkeiten in Betracht zu ziehen, wenn sich dafür aus dem Stand der Technik eine hinreichende Erfolgsaussicht ergab. Auch unter diesem Gesichtspunkt gaben die Ausführungen in TM5 Anlass, die dort beschriebene Formulierung für Budesonid in Erwägung zu ziehen.
In TM5 wird ausgeführt, Flunisolid-Hemihydrat weise eine nennenswerte Löslichkeit in HFA 134a, HFA 227 oder Gemischen davon auf. Dies könne in Suspensionsformulierungen zu einer die Brauchbarkeit der Formulierung gefährdenden Zunahme der Partikelgröße führen. Deshalb wird eine Formulierung in Gestalt einer Lösung als vorteilhaft beurteilt (S. 2 Z. 18 bis S. 3 Z. 2). Die strukturelle Ähnlichkeit von Flunisolid und Budesonid gab dem Fachmann aus den bereits dargelegten Gründen Anlass, vergleichbare Überlegungen auch für Budesonid anzustellen.
Angesichts dessen lag in der Einbeziehung von Formulierungen in Gestalt einer Lösung entgegen der Auffassung der Beklagten weder ein grundlegender Perspektivwechsel noch eine Abkehr von allgemein etablierten Vorgehensweisen. Suspensionen und Lösungen standen auch bei anderen Wirkstoffen, insbesondere bei Flunisolid, als mit jeweils spezifischen Vor- und Nachteilen behaftete, aber grundsätzlich gleichermaßen in Betracht kommende Varianten zur Auswahl. Dass für Budesonid in Verbindung mit HFA-Treibmitteln am Prioritätstag nur Formulierungen auf Basis einer Suspension offenbart waren, gab dem Fachmann keinen Anlass, Hinweise außer Acht zu lassen, die abweichende Konzepte als erfolgversprechend erscheinen ließen. Der Fachmann mag keine Veranlassung gehabt haben, gewissermaßen ins Blaue hinein Versuche mit Lösungsformulierungen anzustellen. Er hatte aber Anlass, konkrete Lösungswege, die sich für andere Wirkstoffe als erfolgreich erwiesen hatten, in Erwägung zu ziehen, wenn die strukturelle Ähnlichkeit dieser Wirkstoffe hinreichend Grund zu der Erwartung gab, dass sich vergleichbare Erfolge auch mit Budesonid einstellen würden. Diese Voraussetzung war bei dem in TM5 für Flunisolid aufgezeigten Lösungsweg aus den bereits dargelegten Gründen erfüllt.
Vor diesem Hintergrund kommt auch dem von der Beklagten hervorgehobenen Umstand, dass trotz der Hinweise in TM5 über mehrere Jahre hinweg keiner der am Markt vertretenen Hersteller eine vergleichbare Formulierung für Budesonid in seinem Angebot hatte, keine ausschlaggebende Bedeutung zu. Dass ein bestimmtes Produkt nicht am Markt verfügbar ist, kann, wie auch die Beklagte in anderem Zusammenhang geltend macht, vielfältige Gründe haben, die nicht zwingend auf technischem Gebiet liegen. Die von der Beklagten angeführte Veröffentlichung ... aus dem Jahr 2003 (Pharmazie unserer Zeit, 32. Jahrgang 2003, Nr. 4, S. 314-322, KW18), in der berichtet wurde, Budesonid sei nach dem Erlöschen der Verkehrsfähigkeit für FCKW-haltige Produkte zum 31. Dezember 2002 nicht mehr in der Form eines Dosieraerosols verfügbar, erlaubt ebenfalls nicht die von der Beklagten postulierte Schlussfolgerung. Zum genannten Zeitpunkt waren mit der Entgegenhaltung TM10 und dem Streitpatent bereits zwei mögliche Wege zur Herstellung eines FCKW-freien Druckinhalators offenbart. Der Umstand, dass dennoch kein entsprechendes Produkt verfügbar war, kann mithin zumindest nicht allein darauf beruhen, dass keine technische Lösung zur Verfügung stand. Dass bei der Entwicklung bis zur Produktreife weitere Probleme zu bewältigen waren, ist für die Beurteilung des Streitpatents irrelevant, weil sich dieses nicht mit der Bewältigung solcher Probleme befasst.
(2) Die in TM10 enthaltenen Ausführungen zu Stabilitätsproblemen führen nicht zu einer abweichenden Beurteilung.
Dabei kann dahingestellt bleiben, ob der in TM10 enthaltene Hinweis, die Budesonid-Suspension dürfe nicht in Kontakt mit Ethanol in Konzentrationen von über fünf Gewichtprozent gebracht werden, weil sich der Wirkstoff sonst lösen würde, was zu Instabilität und Kristallwachstum führe (S. 5 Z. 1-4), nur physikalische Stabilitätsprobleme einer Suspension betrifft, wie sie auch in TM5 beschrieben sind und durch Einsatz einer Lösung gerade überwunden werden. Selbst wenn TM10 zu entnehmen wäre, dass bei einer Budesonid-Lösung mit chemischer Instabilität zu rechnen ist, wurde dem Fachmann in TM5 ein gangbarer Weg aufgezeigt, um solche Probleme zu überwinden.
Auch in diesem Zusammenhang ist nicht ausschlaggebend, dass die Stabilität eines bestimmten Wirkstoffs in einer Lösung im Voraus nicht sicher vorhersehbar ist und dass bei Budesonid möglicherweise mit größeren Stabilitätsproblemen zu rechnen war als bei Flunisolid. Die Ausführungen in TM5 gaben jedenfalls hinreichend Anlass zu der Erwartung, dass die dort aufgezeigten Möglichkeiten zur Verbesserung der Stabilität auch bei Budesonid-Lösungen zu dem angestrebten Erfolg führen würden. Gerade angesichts der Schwierigkeiten, die Stabilitätsprobleme auf theoretischem Weg zu lösen, bestand Veranlassung, sich an bekannten Vorgehensweisen zu orientieren und zu versuchen, diese auf strukturell ähnliche Wirkstoffe zu übertragen.
c) Entgegen der Auffassung der Beklagten kann der Gegenstand von Patentanspruch 1 auch nicht deshalb als auf erfinderischer Tätigkeit beruhend angesehen werden, weil als einziges Mittel zur Stabilisierung die Auswahl eines geeigneten Behältermaterials angegeben wird.
Die Zugabe von weiteren Stoffen zur weiteren Stabilisierung ist nach Patentanspruch 1 zwar nicht zwingend vorgesehen, aber auch nicht ausgeschlossen. Unabhängig davon wird auch in TM5 die Auswahl des Behältermaterials nicht nur als zusätzliches, sondern auch als alleiniges Mittel zur Stabilisierung beschrieben. Dies gab dem Fachmann Anlass, die Auswirkungen des Behältermaterials auf die Stabilität auch ohne Zusatz von Hilfsstoffen zu untersuchen, wie dies auch in dem in TM5 beschriebenen Ausführungsbeispiel 29 geschehen ist.
2. Dass der Gegenstand der auf Patentanspruch 1 zurückbezogenen weiteren elf Patentansprüche hinsichtlich der erfinderischen Tätigkeit anders zu beurteilen wäre, ist weder geltend gemacht noch sonst ersichtlich.
IV. Die Kostenentscheidung beruht auf § 121 Abs. 2 PatG und § 91 Abs. 1 ZPO .
Verkündet am: 31. Juli 2012
Von Rechts wegen